特惠-26考研冲刺
特惠-27考研课
双证-在职硕士
免联考-同等学力
复试分数线
26复试全面指导
模拟复试面试
26考研-全套真题
26考研估分
保研-路线图
27考研-智能择校
27考研-英语测评
27考研-新大纲对比
热门-计算机择校

扫码加入训练营
牢记核心词
学习得礼盒
暨南大学2021年考研自命题大纲已发布,报考暨南大学的考生要认真看考研大纲。预计考研公共课大纲将于9月公布,新东方在线名师将及时为大家解读大纲,洞悉增改考点,更多2021考研英语大纲、考研政治大纲、考研数学大纲、考研专业课大纲解析关注【2021考研大纲解析直播课】,提前免费领《2021考研大纲变动对比手册》。下面是新东方在线考研频道为大家整理的暨南大学2021考研材料综合大纲。
暨南大学材料综合考试大纲(2021年)
《材料综合》满分150分,考试内容包括《基础化学》、《材料科学基础》两门课程内容。考生根据自己的专业背景和未来拟从事的专业研究方向,从中任选其中一门课程内容进行作答。
一、基础化学考试大纲
I 考察目标
基础化学考试涵盖化学热力学、化学动力学、原子结构、胶体和溶液及滴定分析等几个方面的内容。要求考生比较系统的掌握基础化学上述方面的概念、基本原理和方法,能够运用所学的基本原理和基本方法分析、判断和解决有关理论和实际问题。
II 考试形式和试卷结构
1.试卷满分及考试时间
本试卷满分为150分,考试时间为180分钟。
2.答题方式
本试卷答题方式为闭卷、笔试。
3.试卷题型结构
概念题 15分
填空题 20分
选择题 30分
简答题 20分
综合题 65分
III 考察范围
气体与溶液
1.理想气体
分子本身不占体积,分子间没有相互作用力的气体。
2.理想气体方程
pV = nRT
3.道尔顿分压定律
混合气体的总压力等于各组分分压之和。
4.相(概念)
体系中物理性质和化学性质完全相同的一部分称为相。
5.稀溶液的依数性
蒸汽压-> 饱和蒸汽压与难溶电解质溶液的蒸汽压 p=pB* xB;
沸 点-> 沸点、正常沸点、凝固点的概念;
溶质对于溶液沸点和凝固点的影响 △Tb=Kbb,△Tf=Kfb
渗透压-> 渗透与渗透压的概念;
ПV=nRT, П=cRT。
6.胶体溶液
动力性质-> 布朗运动的概念与实质;
光学性质-> 丁达尔现象的概念与实质;
电学性质-> 电泳现象的实质,胶团双电层结构
Zeta电位的定义;
影响溶胶稳定性和导致聚沉的因素;
胶团结构;
高分子溶液与凝胶的特点。
化学热力学基础
1.基本概念
系统、环境、状态、状态函数、过程、途径;
2.热力学第一定律
能量在转化的过程中总值不变(能量守恒定律),△U=Q-W
3.等容反应与等压反应
等容反应->体积保持不变,体系不作体积功,W=0,△U=QV
等压反应->压力保持不变,Qp=H2-H1=△H
4.热化学方程式
定义:表示化学反应与其热效应关系的化学方程式;
热力学标准状态:浓度、压力、温度;
标准焓变
5.盖斯定律
定义:不论化学反应是一步完成还是分步完成,其热效应总是相同的。
6.生成焓
生成焓与标准生成焓的定义与计算;
化学键键能与反应焓变的关系;
7.热力学第二定律
孤立体系的任何自发过程,体系的熵总是增加的。
8.熵与标准摩尔熵
熵->体系混乱度的衡量参数;
热力学第三定律->0K时,任何纯物质的完整晶体的熵值为零;
标准摩尔熵->标准状态下1mol物质的熵值;
熵值大小与聚集态、分子复杂程度、分子量和分子构型的关系。
9.吉布斯自由能
吉布斯自由能也称为自由焓,G=H-TS
吉布斯-赫姆霍兹方程式:对于等温等压过程,△G=△H-T△S
10. 标准平衡常数
标准平衡常数的定义;
气体反应、溶液反应和复相反应的标准平衡常数的表达式;
11.化学平衡
用标准平衡常数判断自发反应方向;
化学平衡的移动(浓度、压力和温度对平衡的影响)
化学反应速率
1.反应速率
反应速率的表示方式: ;
2.基元反应与非基元反应
反应物分子在碰撞中一步直接转化为生成物分子的反应称为基元反应;
3.质量作用定律
基元反应的反应速率与反应物浓度以方程式中化学计量数的绝对值为乘幂的乘积成正比;
反应速率与反应物浓度的关系-> 4.反应速度与温度的关系
5.反应速度理论
碰撞理论->定义、活化能(概念);
过渡态理论->定义;
6.级数反应及其特点
一级反应
二级反应
解离平衡
1.解离平衡常数
对于一元弱酸-> 对于一元弱碱-> 稀释定律->溶液的解离度与浓度的平方根成反比, 同离子效应与盐效应;
2.多元弱酸的解离平衡
3.水的解离与pH标度
水的离子积常数->一定温度下水中氢离子与氢氧根离子浓度乘积为常数
pH= ,pH= ,pOH= ,pH+pOH=14
4.盐类水解
一元强碱弱酸盐的水解-> 一元强酸弱碱盐的水解-> 一元弱酸弱碱盐的水解-> 多元弱酸强碱盐的水解-> 只考虑一级水解
影响盐类水解的因素
5.缓冲溶液
缓冲溶液的原理
缓冲溶液酸度计算公式-> 6.酸碱理论
酸碱的质子论
酸碱的电子论
共轭酸碱
7.沉淀的生成和溶解
溶度积常数的定义和计算
如何判断沉淀是否生成,Qi和 的关系对沉淀的影响及相关计算
氧化还原反应
1.氧化数
氧化数的定义
2.氧化还原反应方程式的配平
3.原电池
原电池的组成与符号表示法
标准电极电势
标准电极电势的应用
4.能斯特方程
电极电位的能斯特方程表示法
溶液浓度对电极电位的影响(能够进行相关计算)
5.吉布斯自由能与电动势的关系
, 能够进行相关计算
6.电极电动势的应用
电极电动势的计算
利用电极电动势判断氧化还原反应的方向
标准电极电动势和平衡常数
原子结构
1.氢光谱与玻尔理论
氢光谱通式-> 玻尔理论的基本假设
自发跃迁的辐射频率 2.波粒二象性 3.测不准原理 4.薛定谔方程
薛定谔方程的写法-> 薛定谔方程的物理意义
波函数 的物理意义
5.量子数
主量子数
角量子数
磁量子数
自旋量子数
6.波函数与电子云图形
波函数角度分布图 电子云角度分布图
电子云径向分布图->r2R2的物理意义;p=R2r2dr;
7.原子核外电子排布
屏蔽效应和穿透效应(概念)
电子排布三规则:保利不相容原理、能量最低原理、洪特规则;
8.原子结构与元素周期律
原子结构与元素性质间的关系
电离能(概念)
电子亲合能(概念)
共价键与分子间力
1.现代价键理论
2.共价键的特性
饱和性、方向性、共价键的类型
3.杂化轨道理论
杂化、杂化轨道的概念;
杂化轨道的特性;
杂化轨道的类型
4.分子轨道理论
分子轨道理论的基本要点;
原子轨道组合成分子轨道的三条原则;
能级图;
分子轨道理论的简单应用
5.分子的极性和分子间作用力
分子间作用力->范德华力(静电力、诱导力、色散力)
范德华力的特点
6.氢键
氢键的形成
分子内氢键与分子间氢键
氢键的两个特性
配位化合物
1.配位化合物
配位化合物的定义
配位原子(概念)、配位数(概念)
配合物的命名
2.配合物的化学键本质
价键理论->α配键与π配键,内轨与外轨配合物
滴定分析
1. 标准溶液的配制
2. 滴定分析的计算
3. 分析结果的误差
偶然误差
系统误差
偏差
准确度
精密度
4. 酸碱滴定
常见酸碱指示剂及其变色范围
酸碱标准溶液的配制和标定
5. 氧化还原滴定
高锰酸钾法的原理
高锰酸钾标准溶液的配制和标定
碘量法
碘量法标准溶液的配制和标定
碘量法的应用
IV 试题示例
如果体系经过一系列变化,最后又变回初始状态,则体系的
A. Q=0,W=0,△U=0,△H=0; B. Q≠0,W≠0,△U=0,△H=Q;
C. Q=-W,△U=Q+W,△H=0; D. Q≠W,△U=Q+W,△H=0;
下列物质中,不属于其共轭酸碱的是
A. NH4+,NH3; B. HF,H2F+; C. NH3,NH2-; D. H3O+,OH-
下列分子中,偶极矩为零的是
A. NF3; B. NO2; C. PCl3; D. BCl3
下列氯化物中,熔点最低的是
A. HgCl2; B. FeCl3; C. FeCl2; D. ZnCl2
下列分子和离子中,键能最大的是
A. N2; B. O2+; C. NO; D. CN-
下列分子和离子中,具有顺磁性的是
A. NO+; B. [Fe(CN)6]4-; C. B2; D. CO
下列物质中,还原性最强的是
A. HF; B. PH3; C. NH3; D. H2S
同物质的量浓度的下列离子在酸性介质中,氧化性最强的是
A. SO42-; B. ClO-; C. ClO4-; D. H3IO62-
硫酸亚硝酸根五氨合钴(III)的化学式是_______
(NH4)3[CrCl(SCN)4]的学名是____________;
自然界中硬度最大的单质是_______________;熔点最高的金属元素是____________.
(综合题)通过杂化轨道理论说明SiCl4、PCl3、OF2的分子几何构型并解释其中键角的变化。
(综合题)将无色硝酸盐A加入水中,生成白色沉淀B和澄清溶液C。向C中通入H2S生成黑色沉淀D,D不溶于NaOH溶液,但可以溶于盐酸。向C中滴加NaOH溶液生成白色沉淀E,E不溶于过量NaOH溶液,试写出A、B、C、D、E的化学式。
(综合题)现代价键理论和分子轨道理论在讨论共价分子成键时,最主要的区别是什么?分析氧气具有顺磁性时哪种理论更合理?
(综合题)CHCl3在40摄氏度的蒸汽压为49.3kPa,在此温度下98.6kPa压力下,4升空气(综合题)通过CHCl3,求(1)空气和CHCl3混合气体的体积是多少?(2)被空气带走的CHCl3质量是多少?
(综合题)在250ml容器中装入未知气体101.3kPa,此气体的质量为0.164克,试验温度为25摄氏度,求该气体的相对分子质量。
(综合题)450克水蒸气在101.3kPa和100摄氏度下凝结成水,已知水的蒸发热为2.26kJg-1,计算此过程的W、△H和△U。
(简答题)下列说法是否正确,为什么?(1)放热反应都能自发进行;(2)熵值变大的反应都能自发进行;(3) 的反应都能自发进行;(4)稳定单质规定它的 ;(5)生成物的分子数比反应物多,该反应的
(综合题)对于反应4HBr(g)+O2(g)->2H2O(g)+2Br2(g),(1)在一定温度下测HBr起始浓度为0.0100M,10s后HBr的浓度为0.0082M,计算反应在10s内的平均速率;(2)如果上述数据是O2的浓度,则该反应的平均速率又是多少?
(综合题)301K时牛奶变酸需要4h,但是在278K的冰箱中则需要48h,嘉定反应速率与便算时间成反比,试计算牛奶变酸的活化能。
(综合题)PCl5加热后,分解反应式为PCl5(g)=PCl3(g)+Cl2(g),在10L密闭容器中装有2mol PCl5,某温度时有1.5mol PCl5分解,求该温度下的KΘ。若在该密闭容器中通入1mol Cl2,PCl5的分解百分数为多少?
(综合题)酯化反应C2H5OH(l)+CH3COOH(l)=CH3COOC2H5(l)+H2O(l)可近似看做理想溶液反应。在298K时,若将2mol C2H5OH与2mol CH3COOH混合,平衡时各种物质有2/3变为生成物。今将138克C2H5OH与120克CH3COOH在298K混合,求平衡混合物中有多少CH3COOC2H5生成?
(简答题)下列说法是否正确,为什么?(1)凡是盐都是强电解质;(2)BaSO4,AgCl难容于水,水溶液导电不显著,故为弱电解质;(3)解离作用是先通电,然后解离,溶液就能导电了;(4)氨水稀释一倍,溶液中的c(OH-)就减少为原来的一半;(5)HCl溶液的浓度为HAc溶液浓度的一倍,则前者的c(H+)也是后者的一倍。
(综合题)要配置250mL,pH值等于5的缓冲溶液,需要在125mL 1M的NaAc溶液中加多少6M的HAc和水?
(简答题)用质子论判断下列物质那些是酸,哪些是碱,哪些即使酸又是碱?(1)[Al(H2O)6]3+;(2)HS-;(3)CO32-;(4)H2PO4-;(5)NH3;(6)HSO4-;(7)NO3-;(8)HCl;(9)Ac-;(10)OH-;(11)H2O
(综合题)0.01M的BaCl2溶液5mL,稀释到1000mL,加入0.01M的K2SO4溶液0.5mL,有无沉淀析出?
(简答题)配平下列化学反应方程式:
(1)As2O3+HNO3+H2O->H3AsO4+NO;(2)K2Cr2O7+H2S+H2SO4->K2SO4+Cr2(SO4)3+S+H2O;
(3)K2MnO4+H2O->KmnO4+MnO2+KOH;(4)KOH+Br2->KBrO3+KBr+H2O
(5)Zn+HNO3->Zn(NO3)2+NH4NO3+H2O;(6)I2+Cl2+H2O->HCl+HIO3
(7)MnO4-+H2O2+H+->Mn2++O2+H2O
(综合题)如下反应H2+ O2=H2O,ΔrGΘ=-237kJ·mol-1和C+O2=CO2, ΔrGΘ=-394kJ·mol-1;都能设计成原电池,计算它们的电动势EΘ。
(综合题)利用玻尔理论的轨道能量公式,计算氢原子的电子从第五能级跃迁到第二能级所释放的能量及谱线的波长。
(简答题)简述四个量子数的物理意义和量子化条件。
(综合题)KI的晶格能(U)为-631.9kJmol-1,钾的升华热S(K)为90.0 kJmol-1,钾的电离能(I)为418.9 kJmol-1,碘的升华热S(I2)为62.4 kJmol-1,碘的离解能(D)为151 kJmol-1,碘的电子亲合能(E)为310.5 kJmol-1,求碘化钾的生成热(ΔfH)。
(综合题)试用杂化轨道理论说明BF3是平面三角形而NF3却是三角锥形。
(综合题)根据分子轨道理论判断O2+、O2、O2-、O22-的键级和单电子数。
(简答题)下列说法是否正确,为什么?(1)分子中的化学键为极性键,则分子也是极性分子;(2)色散力仅存在于非极性分子之间;(3)3电子π键比2电子π键的键能大。
(综合题)CN-于Ag+、Ni2+、Fe3+和Zn2+形成配离子,试根据价键理论讨论其杂化类型、几何构型和磁性。
V 基础化学主要参考书
1. 魏祖期,基础化学,人民卫生出版社
2. 董元彦,无机及分析化学(第二版),科学出版社
二、材料科学基础考试大纲
I 考察目标
材料科学基础是材料科学与工程、金属材料、材料物理、材料化学、无机非金属材料及相关专业的重要学科基础课,涵盖了固体材料微结构、晶体缺陷、扩散理论、形变规律、相图等方面的基础知识。本课程考试旨在考查考生是否了解材料科学中的共性规律,即材料的组成-形成(工艺)条件-结构-性能-材料用途之间相互关系及制约规律,考查学生是否能够运用材料科学的基本原理解决实际问题。
II 考试形式和试卷结构
1.试卷满分及考试时间
本试卷满分为150分,考试时间为180分钟。
2.答题方式
本试卷答题方式为闭卷、笔试。
III 考察内容和范围
一、金属及合金的晶体结构
1、原子结构与原子键合。
2、金属键与金属的特性。
3、晶体学基础:晶体结构、空间点阵、晶格常数、晶向指数和晶面指数、晶面间距、三种典型金属晶体结构。
4、合金相分类及影响合金相结构的主要因素、固溶体与固溶强化(置换式固溶体、间隙式固溶体、有序固溶体)、中间相及分类。
二、晶体中的缺陷
1、点缺陷。
2、位错的概念及基本性质、基本类型、几何性质及其运动特点;面心立方晶体中的位错与位错反应;位错与金属的强化机制。
3、面缺陷:晶界,孪晶界,相界,外表面。
三、固体金属中的扩散
1、扩散现象及表象理论。
2、扩散热力学分析。
3、扩散的微观理论及微观机制,扩散激活能。
4、影响扩散的因素。
四、金属的塑性变形与再结晶
1、弹性与粘弹性。
2、单晶体塑性变形的基本方式;多晶体的塑性变形;合金的塑性变形;塑性变形后金属和合金显微组织及性能变化。
3、冷变形金属在加热过程中的组织结构及性能变化,回复、再结晶、晶粒长大;再结晶退火后的组织。
4、热变形与动态回复、再结晶。
五、单组元相图与纯金属的凝固
1、单元系相变的热力学及相平衡。
2、纯金属的凝固。
六、二元合金相图及二元合金的凝固
1、相图的表示和测定方法。
2、相图的热力学的基本要点。
3、二元相图分析:匀晶、共晶、包晶相图及固溶体二元合金的凝固;Fe-C合金相图及典型成分Fe-C合金凝固过程及凝固组织分析。
4、二元相图的凝固理论。
七、三元相图
1、直线法则、杠杠定律、重心法则。
2、三元匀晶相图及合金凝固过程分析。
3、三元共晶相图及典型合金凝固过程分析与凝固组织,四相平衡转变及三元相图所遵循的一般规律。
八、材料的亚稳态
1、纳米晶材料。
2、固态相变形成的亚稳相:固态相变概述、固溶体脱溶分解产物、马氏体相变的基本特征。
IV 试卷结构
1、基本知识与基本概念题 (约50分)。
2、理论分析论述题 (约50分)。
3、计算与作图题(约50分)。
V 材料科学基础主要参考书
1. 胡赓祥等,材料科学基础(第三版),上海交通大学出版社。
2. 石德珂等,材料科学基础(第二版),机械工业出版社。
新东方在线将在2021考研大纲发布第一时间为大家带来2021考研大纲解析直播课(点击图片免费领取),带大家第一时间了解2021年考研大纲变动。

【专业课必备:2026考研自命题考试大纲】
【查询2026考研招生人数、招生专业、参考书】

 资料下载
资料下载
2014年-2025年考研历年真题汇总
发布时间:2024-04-25扫码添加【考研班主任】
即可领取资料包
考研大纲PDF电子版下载-历年(附解析)
发布时间:2024-04-25扫码添加【考研班主任】
即可领取资料包
2026年考研政数英备考资料zip压缩包
发布时间:2024-04-25扫码添加【考研班主任】
即可领取资料包
考研英语大纲词汇5500打印版(基础必备)
发布时间:2024-04-25扫码添加【考研班主任】
即可领取资料包
新东方在线考试模拟题【12套】
发布时间:2024-04-25扫码添加【考研班主任】
即可领取资料包
2026年考研专业课知识点总结
发布时间:2024-04-25扫码添加【考研班主任】
即可领取资料包
新东方考研资料下载地址
发布时间:2023-05-17新东方在线考研资料合集
下载方式:微信扫码,获取网盘链接

目录:
1.2013-2023年近10年政数英真题及解析PDF版(新东方)
2.2013-2023年专业课考试历年真题及解析PDF版
3.24考研复习备考资料大合集:大纲+备考资料+词汇书+考前押题+自命题
资料介绍:
1.2013-2023年近10年政数英真题及解析PDF版(新东方)
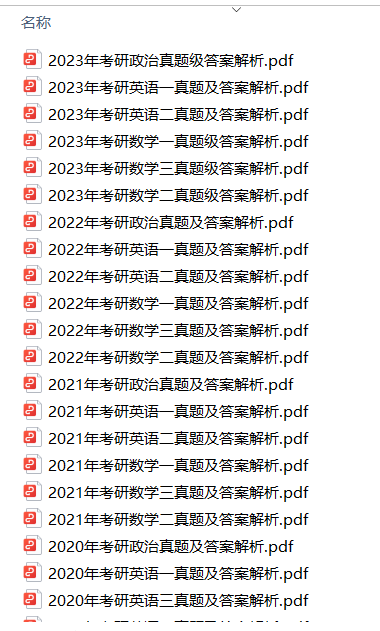 、
、
2.2013-2023年专业课考试历年真题及解析PDF版

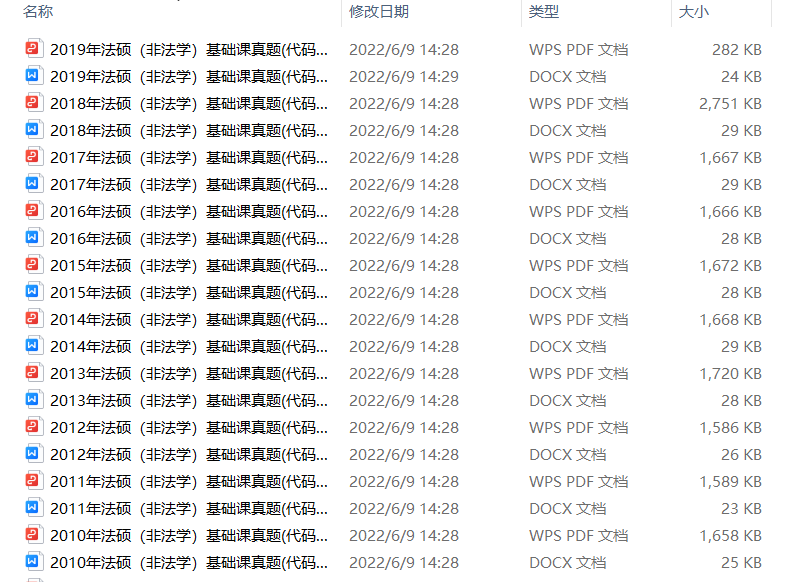
3.24考研复习备考资料大合集
3.24考研复习备考资料:考研大纲
3.24考研复习备考资料:政数英备考资料+自命题真题
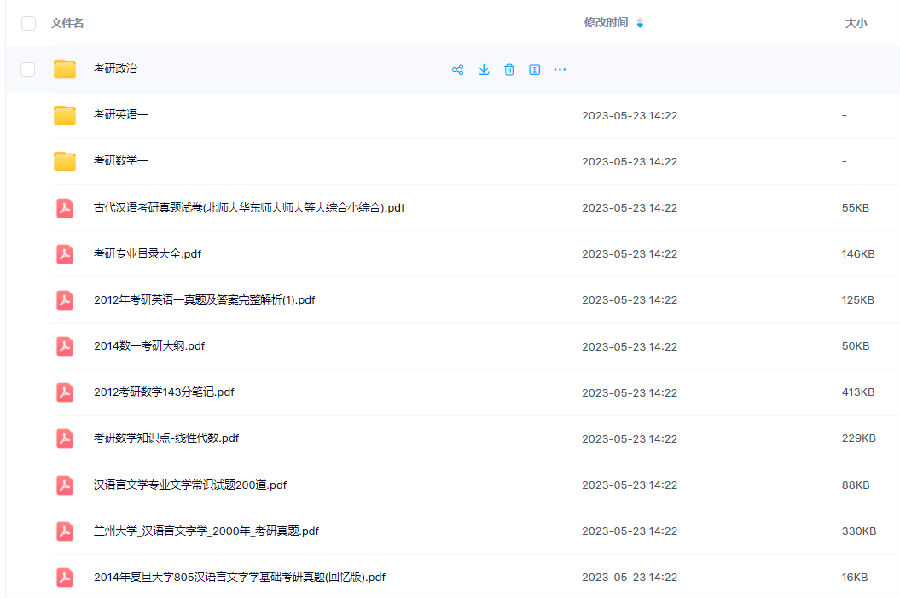
------------------
考研备考过程中,尤其是专业课部分,参考往年的考试真题,对于我们的复习有更好的帮助。北京大学考研真题资料都有哪些?小编为大家进行了汇总。
北京大学考研真题资料-公共课
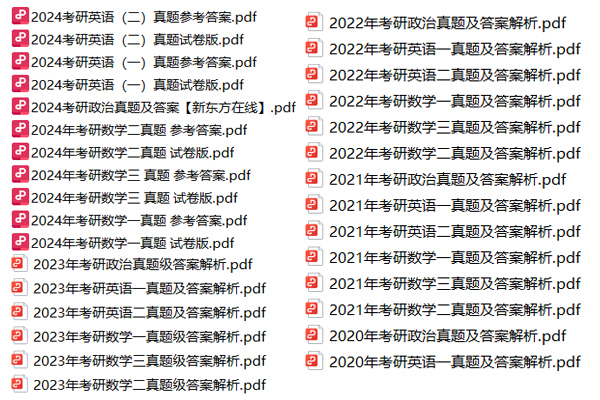
北京大学考研真题资料-专业课


以上就是关于“北京大学考研真题资料下载(历年汇总)”的整理,更多考研资料下载,请关注微信获取下载地址。
2024考研公共课必背知识点汇总
发布时间:2023-01-03扫码添加【考研班主任】
即可领取资料包
2013-2023考研历年真题汇总
发布时间:2023-01-03扫码添加【考研班主任】
即可领取资料包
考研英语大纲词汇(PDF可打印)
发布时间:2023-01-03扫码添加【考研班主任】
即可领取资料包
2024考研专业课知识点总结
发布时间:2023-01-03扫码添加【考研班主任】
即可领取资料包
2023考研政治 内部押题 PDF
发布时间:2022-11-16扫码添加【考研班主任】
即可领取资料包
徐涛:23考研预测六套卷
发布时间:2022-11-16扫码添加【考研班主任】
即可领取资料包
考研政数英冲刺资料最新整理
发布时间:2022-11-16扫码添加【考研班主任】
即可领取资料包
23考研答题卡模板打印版
发布时间:2022-11-16扫码添加【考研班主任】
即可领取资料包
2023考研大纲词汇5500PDF电子版
发布时间:2022-07-28扫码添加【考研班主任】
即可领取资料包
考研历年真题(公共课+专业课)
发布时间:2022-07-28扫码添加【考研班主任】
即可领取资料包
考研英语阅读100篇附解析及答案
发布时间:2022-01-07扫码添加【考研班主任】
即可领取资料包
新东方考研学霸笔记整理(打印版)
发布时间:2022-01-07扫码添加【考研班主任】
即可领取资料包
2001-2021年考研英语真题答案(可打印版)
发布时间:2022-01-07扫码添加【考研班主任】
即可领取资料包
考研英语词汇5500(完整版下载)
发布时间:2022-01-07扫码添加【考研班主任】
即可领取资料包
2022考研政审表模板精选10套
发布时间:2022-01-07扫码添加【考研班主任】
即可领取资料包
历年考研真题及答案 下载
发布时间:2021-12-09扫码添加【考研班主任】
即可领取资料包
考研政审表模板汇总
发布时间:2020-06-17扫码添加【考研班主任】
即可领取资料包
近5年考研英语真题汇总
发布时间:2020-06-17扫码添加【考研班主任】
即可领取资料包
考研英语大纲词汇5500
发布时间:2020-06-17扫码添加【考研班主任】
即可领取资料包
2022考研12大学科专业排名汇总
发布时间:2019-11-21扫码添加【考研班主任】
即可领取资料包
2023考研政治复习备考资料【珍藏版】
发布时间:2019-11-21扫码添加【考研班主任】
即可领取资料包
考研英语万能模板+必备词汇+范文
发布时间:2019-11-21扫码添加【考研班主任】
即可领取资料包
考研数学一、二、三历年真题整理
发布时间:2019-11-21扫码添加【考研班主任】
即可领取资料包

添加班主任领资料
添加考研班主任
免费领取考研历年真题等复习干货资料

 推荐阅读
推荐阅读
在考研备考过程中,各院校公布的自命题考试大纲对专业课复习具有重要指导意义。及时获取并深入研究目标院校的自命题大纲,能够帮助考生
来源 : 新东方在线 2025-08-14 14:45:23 关键字 :
2026年全国硕士研究生入学统一考试 《音乐综合分析与应用》考试大纲 一、试卷满分及考试时间 试卷满分为150分,考试时间3小时
来源 : 网络 2025-08-14 08:31:00 关键字 : 考研大纲及参考书目
2026年全国硕士研究生入学统一考试 《音乐教育学》考试大纲 一、试卷满分及考试时间 试卷满分:150分 考试时间:3小时
来源 : 网络 2025-08-14 08:31:00 关键字 : 考研大纲及参考书目
2026年全国硕士研究生入学统一考试 《艺术基础》考试大纲 一、试卷满分及考试时间 试卷满分 150分 考试时间 3小时 二
来源 : 网络 2025-08-14 08:32:00 关键字 : 考研大纲及参考书目
2026年全国硕士研究生入学统一考试《舞蹈艺术理论》 考试大纲 (一)舞蹈的本质和审美特征 1 舞蹈的艺术本质 2 舞蹈的社
来源 : 网络 2025-08-14 08:32:00 关键字 : 考研大纲及参考书目

 资料下载
资料下载
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
新东方在线考研资料合集
下载方式:微信扫码,获取网盘链接

目录:
1.2013-2023年近10年政数英真题及解析PDF版(新东方)
2.2013-2023年专业课考试历年真题及解析PDF版
3.24考研复习备考资料大合集:大纲+备考资料+词汇书+考前押题+自命题
资料介绍:
1.2013-2023年近10年政数英真题及解析PDF版(新东方)
 、
、
2.2013-2023年专业课考试历年真题及解析PDF版


3.24考研复习备考资料大合集

3.24考研复习备考资料:考研大纲

3.24考研复习备考资料:政数英备考资料+自命题真题

------------------
考研备考过程中,尤其是专业课部分,参考往年的考试真题,对于我们的复习有更好的帮助。北京大学考研真题资料都有哪些?小编为大家进行了汇总。
北京大学考研真题资料-公共课

北京大学考研真题资料-专业课


以上就是关于“北京大学考研真题资料下载(历年汇总)”的整理,更多考研资料下载,请关注微信获取下载地址。
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包

 阅读排行榜
阅读排行榜
 相关内容
相关内容