特惠-26考研冲刺
特惠-27考研课
双证-在职硕士
免联考-同等学力
复试分数线
26复试全面指导
模拟复试面试
26考研-全套真题
26考研估分
保研-路线图
27考研-智能择校
27考研-英语测评
27考研-新大纲对比
热门-计算机择校

扫码加入训练营
牢记核心词
学习得礼盒
(二)物理化学:
1、物质的pVT关系和热性质
(1) 理解pVT关系和热性质是物质的两类基本的宏观平衡性质。掌握系统、环境、状态、平衡态、状态函数、强度性质、广延性质等基本概念,以及反映物质pVT关系的状态方程。
(2) 掌握流体的pVT状态图、pV图和压缩因子图的特点,气液相变和气液临界现象的特征,以及饱和蒸气压、沸点和临界参数的物理意义。理解包括气液固三相的pVT状态图,掌握pT相图的特点以及三相点的意义,理解稳定平衡和亚稳平衡的区别和联系。
(3) 理解范德华方程及其对气液相变的应用。了解什么是双节线,什么是旋节线。理解普遍化范德华方程。掌握pVT关系的普遍化计算方法。理解对应状态原理。
(4) 掌握热力学第一定律。掌握功、热、热力学能、焓等的定义和相互关系,理解 、 的适用条件和应用,及热力学标准状态的概念和意义。
(5) 掌握标准摩尔定容热容、标准摩尔定压热容、标准摩尔相变焓、标准摩尔生成焓、标准摩尔燃烧焓和标准熵的定义和应用。
(6) 了解热性质的实验测定原理和方法以及一些半经验方法。
2、 热力学定律和热力学基本方程
(1) 理解热力学第二定律的建立过程。理解由热力学第二定律演绎得出的三个结论,即热力学温标、存在一个状态函数熵、以及熵增原理。理解引入亥姆霍兹函数和吉布斯函数的意义。
(2) 掌握在克劳修斯不等式基础上得出的可逆性判据或不可逆程度的度量。
(3) 掌握热力学基本方程,理解由此得出的各种偏导数关系式。理解热力学基本方程是化学热力学理论框架的中心。
(4) 掌握理想气体pVT变化中热力学函数变化的计算。了解非理想气体包括液体和固体pVT变化中热力学函数变化的计算。
(5) 掌握可逆相变化和不可逆相变化中热力学函数变化的计算。
(6) 理解热力学第三定律的建立过程,理解标准熵的含义。了解得到标准熵的方法。
(7) 掌握化学变化中热力学函数变化的计算。
(8) 理解可逆性判据与平衡判据的联系,并用它们判断过程的方向和限度。
(9) 掌握克拉佩龙–克劳修斯方程的推导和应用。
3、 多组分系统的热力学,逸度和活度
(1) 理解偏摩尔量的定义与物理意义,理解集合公式和吉布斯–杜亥姆方程,了解偏摩尔量的实验测定。
(2) 理解化学势的定义,掌握组成可变的均相多组分系统和多相多组分系统的热力学基本方程,理解它们是多组分系统热力学的中心。
(3) .理解用化学势表达的适用于相变化和化学变化的平衡判据,掌握热平衡条件、力平衡条件、相平衡条件和化学平衡条件。
(4) 理解相律的推导,掌握相律的内容及其应用。
(5) 理解逸度和逸度参考状态的概念,能用逸度表示混合物中组分的化学势。了解逸度因子的求法。
(6) 理解理想混合物和理想稀溶液的概念,掌握拉乌尔定律、亨利定律及其应用。
(7) 理解活度的概念,掌握选取活度参考状态的惯例Ⅰ和惯例Ⅱ,能用活度表示液态(固态)混合物中组分以及溶液中溶剂和溶质的化学势,能用混合物或溶液的蒸气压数据求组分的活度因子。了解选择活度参考状态的惯例Ⅲ和惯例Ⅳ。
4、 相平衡
(1) 掌握两组分系统的气液平衡,理解恒温相图和恒压相图中点、线、面的物理意义,会使用杠杆规则计算平衡时各相的量,理解精馏的原理。了解两组分系统的高压气液平衡相图。
(2) .对两组分系统的液液气平衡相图,掌握恒压相图中点、线、面的物理意义,会使用相律和杠杆规则,理解液相部分互溶系统的精馏。
(3) .对两组分系统的液固平衡相图,了解用热分析法和溶解度法制作相图的方法,掌握几种典型液固相图的点、线、面的物理意义,会使用相律和杠杆规则,了解液固平衡相图的实际应用。
(4) 对于三组分系统的相图,会用正三角形的组成表示法,了解三组分系统液液平衡相图或三组分系统液固平衡相图的特点,知道投影图的概念。了解萃取和结晶分离的依据和原理,了解分配定律。
(5) 掌握相平衡计算的原理,了解各类型相平衡计算的内容和方法。
(6) 了解稀溶液依数性的热力学原理以及一些重要应用。
5、化学平衡
(1) 了解标准平衡常数的定义和特性。了解以逸度、分压、浓度、活度、摩尔分数表示的平衡常数的形式和特性,及与标准平衡常数的关系。
(2) 了解化学反应等温方程的推导,掌握用等温方程判断化学反应方向与限度的方法。
(3) 了解同时平衡和反应耦合的概念。
(4) 了解范特荷甫方程的推导,理解温度对标准平衡常数的影响规律,掌握使用范特荷甫方程计算不同温度下标准平衡常数的方法。
(5) 熟练掌握用热性质数据计算标准平衡常数的方法。
6、 化学动力学
(1) 理解基元反应、复合反应,以及它们之间的关系。
(2) 掌握化学反应速率的各种定义以及相互间的关系。理解反应分子数、级数、速率常数和速率系数的概念和含义。
(3) 掌握零级、一级、二级、n 级反应速率方程的特点以及它们的积分形式,了解它们的应用。
(4) 掌握一级对峙反应、一级连串反应和一级平行反应的基本特点以及它们的积分形式,了解它们的应用。
(5) 掌握不同形式的阿仑尼乌斯方程及其应用,理解阿仑尼乌斯活化能和指前因子的含义。
(6) 掌握利用实验数据获得动力学特征参数的积分法和微分法。
(7) .掌握由反应机理求速率方程的近似方法——平衡态处理法和恒稳态处理法。
(8) 了解基元反应的三个速率理论即碰撞理论、过渡状态理论和分子动态学的概要。
(9) 了解求动力学特性参数的半经验方法。
(10)理解分子聚合反应和自由基聚合反应速率方程特点,了解链反应机理基本特点。
(11)理解光化学反应的基本定律以及速率方程的特点。
7、 独立子系统的统计热力学
(1) .了解独立子系统与相倚子系统的概念与本质区别。知道系统的微观状态的经典力学描述与量子力学描述。理解平动能级、转动能级、振动能级以及电子能级等,是需要输入的物质的微观特性。
(2) 理解统计力学的三个基本假定,理解独立子系统的微观状态、分布和宏观状态间的关系。
(3) 理解最概然分布可以代表平衡系统中一切分布的统计规律,掌握撷取最大项法。
(4) 理解麦克斯韦–玻尔兹曼分布公式的不同表示形式及其适用条件。了解玻色–爱因斯坦和费米–狄拉克分布,以及三种分布间的关系。
(5) 理解子配分函数的物理意义和析因子性质。掌握双原子分子的平动、转动和振动配分函数的计算。
(6) 掌握独立子系统的热力学函数与子配分函数的关系。理解能量按自由度均分原理和玻尔兹曼关系式。
(7) 了解气体标准摩尔热容的统计力学计算方法,了解原子晶体热容的爱因斯坦模型和德拜模型。
(8) 了解标准摩尔熵和气相化学反应标准平衡常数的统计力学计算方法。
8、 界面现象
(1) 理解界面张力和单位界面过剩量的意义。理解定义界面过剩量的吉布斯方法。
(2) .理解有界面相的系统的热力学基本方程和平衡条件。理解热力学函数与界面张力、界面面积和界面过剩量的关系。
(3) 掌握拉普拉斯方程、开尔文方程以及吉布斯等温方程的推导,理解其物理含义,并能应用它们来解释弯曲界面两边的压差、弯曲界面的饱和蒸气压、亚稳平衡、正吸附和负吸附等重要界面现象。
(4) 了解润湿和铺展等界面现象的热力学基础。
(5) 了解获得各类界面平衡特性的实验方法、半经验方法和理论方法。
(6) 理解气体在固体表面的物理吸附和化学吸附概念,掌握各种半经验模型,特别是兰缪尔模型、BET多层吸附模型的意义和应用,理解毛细管凝结现象的原因。
(7) 了解动态界面张力、单分子膜中化学反应以及多相催化作用的特点。
(8) 理解多相催化反应的基本步骤和动力学速率方程的特点,了解扩散控制、吸附控制和界面反应控制的区别。
9、 电解质溶液与电化学:
(1) 理解电解质活度、离子活度、离子平均活度、溶剂活度和溶剂渗透因子的定义。了解它们的特点和变化规律。
(2) 理解离子互吸理论的要点。了解在此基础上发展的电解质溶液理论的半经验方法。
(3) 了解电解质溶液活度应用的一些特点。
(4) 理解电解质溶液的导电机理。理解电迁移率、迁移数、电导率、摩尔电导率和离子摩尔电导率的定义和物理意义,以及它们间的相互关系。掌握它们的计算和相互换算。
(5) 掌握电导测定对离解平衡的应用。
(6) 理解电化学反应与一般化学反应的区别和联系。
(7) 理解电动势、电池电势、电池反应电势、电池反应标准电势和电池反应条件电势的区别;理解电极电势、电极反应电势、电极反应标准电势和电极反应条件电势的区别;理解电极反应电势和电极反应绝对电势的区别。了解电池、电极和电极反应的书写惯例,以及电极正负极性的确定等。
(8) 理解电化学系统的热力学基本方程、电化学势和电化学平衡判据。
(9) 掌握电池反应和电极反应的能斯特方程,掌握采用标准氢电极定义电极反应电势和标准电势的原理,掌握电池反应电势和电极反应电势的计算方法及应用。
(10)理解浓差电池的原理,了解液接电势的计算。
(11)了解外电势、表面电势和内电势的物理意义,以及它们与电极电势的关系。了解各种双电层模型及其实验依据。了解电极反应绝对电势是如何确定的。
(12)理解超电势的含义和塔费尔方程,了解传递对超电势的影响。
(三)生物化学:
1、绪 论
了解生物化学的涵义、生物化学的研究范围、其与基础学科以及生命科学的关系、生物化学在工农业生产和医药中的应用。
2、糖类化合物
了解单糖、寡糖、多糖和糖复合物的概念。
3、脂类化合物
了解脂酰甘油类、磷脂类、萜类和类固醇类、前列腺素及蜡类、结合脂类以及生物膜的结构与功能。
4、蛋白质化学
了解蛋白质的功能、蛋白质的基本结构单位氨基酸、蛋白质的分子结构及与功能关系、蛋白质的性质以及蛋白质研究技术。
5、核酸
了解核酸的种类和生物功能、核苷酸、DNA和RNA的结构、核酸的物理化学性质以及核酸的研究的技术。
6、酶化学
了解生物催化剂的基本概念、酶促反应动力学、酶活力测定、酶作用的机制与药物分子的设计、寡聚酶、同工酶和固相酶的概念以及酶的应用
7、生物氧化
了解生物氧化的特点与方式、线粒体的生物氧化体系、生物氧化过程中能量的转变以及非线粒体的生物氧化体系
8、糖代谢
了解糖的消化与糖的中间代谢的概念、了解糖的分解代谢(糖酵解、三羧酸循环、磷酸己糖旁路)、糖的合成代谢(糖异生、糖原的合成、光合作用)以及如何利用代谢调节生产发酵产品的概念
9、脂类代谢
了解脂类消化和中间代谢的基本概念、脂肪的分解代谢(β-氧化)、脂肪酸及脂类的合成代谢
10、蛋白质的分解代谢
了解蛋白质的酶促降解、氨基酸的分解代谢(脱氨、脱羧)以及氨基酸代谢产物的进一步代谢(尿素循环、一碳基团代谢等)
11、核苷酸的代谢
了解核酸的酶促降解、嘌呤核苷酸的生物合成(从头合成与补救途径)、嘧啶核苷酸的生物合成(从头合成与补救途径)、以及核苷酸合成与抗代谢物的关系。
12、核酸的生物合成
了解DNA的生物合成(半保留、半不连续复制;DNA的复制有关的酶和蛋白质;DNA复制的基本过程;逆向转录;基因突变和DNA的损伤修复);RNA的生物合成(RNA聚合酶;RNA的转录过程;转录后的加工;RNA的复制)。
13、蛋白质的生物合成
了解mRNA和遗传密码、翻译相关的生物大分子、蛋白质的合成过程(氨基酸的活化;肽链合成的起始、肽链的延伸、终止与释放;肽链合成后的加工与折叠等。
14、代谢调节综述
了解细胞水平的代谢调节、激素水平的代谢调控和神经水平的代谢调控;常见代谢途径及相互影响

 资料下载
资料下载
2014年-2025年考研历年真题汇总
发布时间:2024-04-25扫码添加【考研班主任】
即可领取资料包
考研大纲PDF电子版下载-历年(附解析)
发布时间:2024-04-25扫码添加【考研班主任】
即可领取资料包
2026年考研政数英备考资料zip压缩包
发布时间:2024-04-25扫码添加【考研班主任】
即可领取资料包
考研英语大纲词汇5500打印版(基础必备)
发布时间:2024-04-25扫码添加【考研班主任】
即可领取资料包
新东方在线考试模拟题【12套】
发布时间:2024-04-25扫码添加【考研班主任】
即可领取资料包
2026年考研专业课知识点总结
发布时间:2024-04-25扫码添加【考研班主任】
即可领取资料包
新东方考研资料下载地址
发布时间:2023-05-17新东方在线考研资料合集
下载方式:微信扫码,获取网盘链接

目录:
1.2013-2023年近10年政数英真题及解析PDF版(新东方)
2.2013-2023年专业课考试历年真题及解析PDF版
3.24考研复习备考资料大合集:大纲+备考资料+词汇书+考前押题+自命题
资料介绍:
1.2013-2023年近10年政数英真题及解析PDF版(新东方)
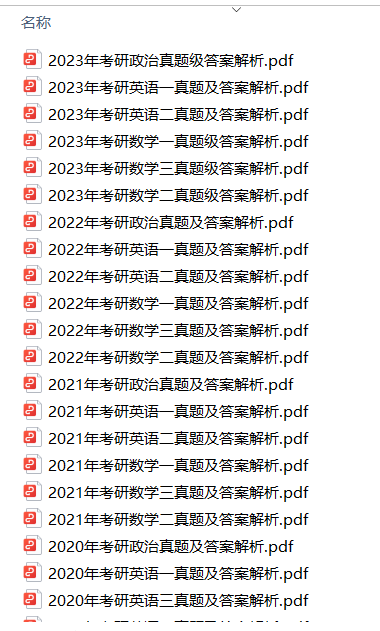 、
、
2.2013-2023年专业课考试历年真题及解析PDF版

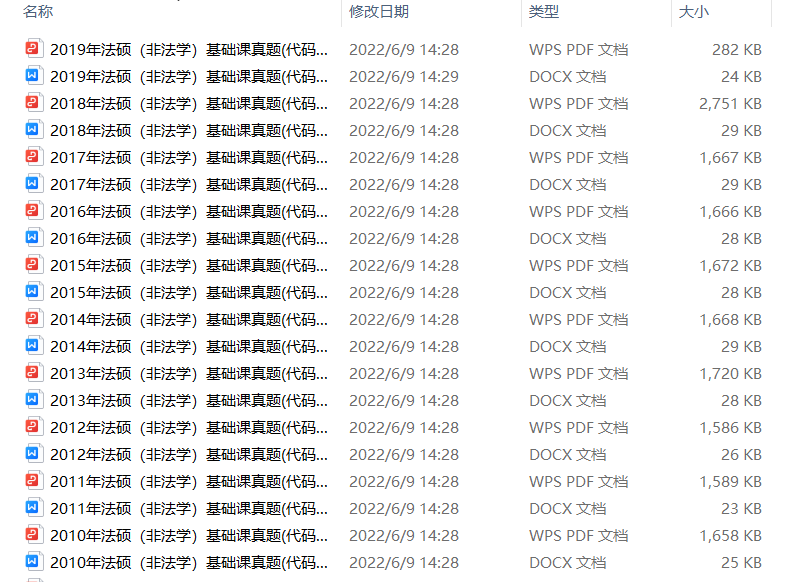
3.24考研复习备考资料大合集
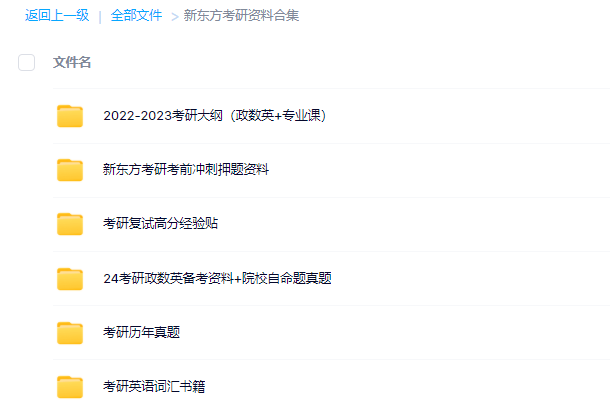
3.24考研复习备考资料:考研大纲
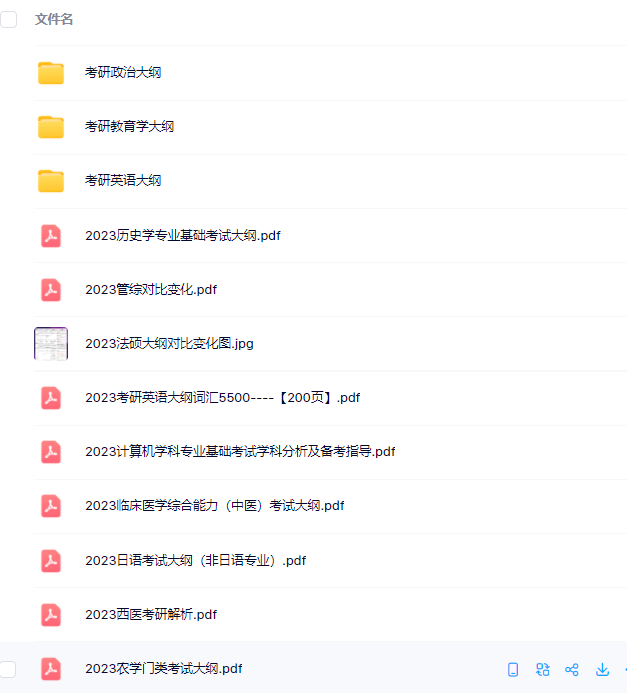
3.24考研复习备考资料:政数英备考资料+自命题真题
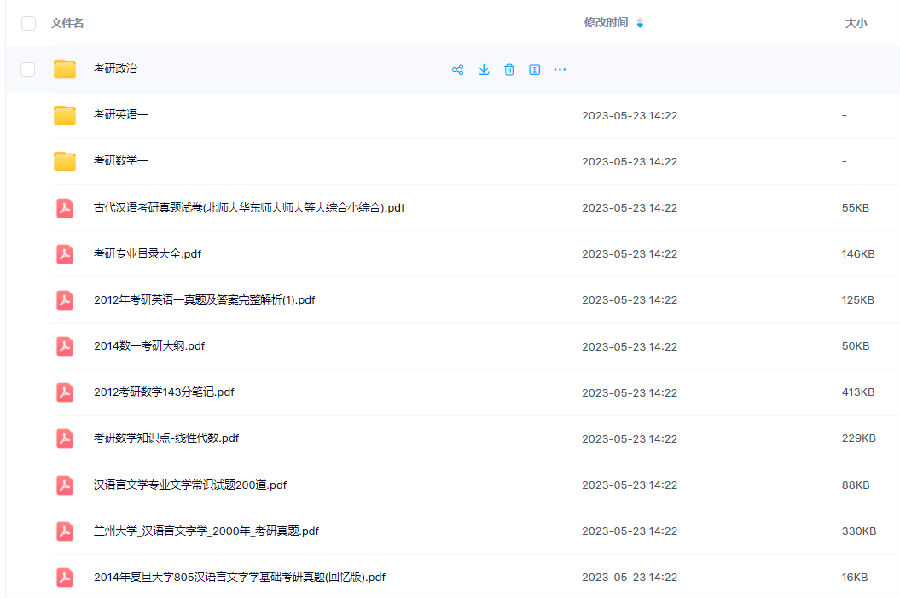
------------------
考研备考过程中,尤其是专业课部分,参考往年的考试真题,对于我们的复习有更好的帮助。北京大学考研真题资料都有哪些?小编为大家进行了汇总。
北京大学考研真题资料-公共课
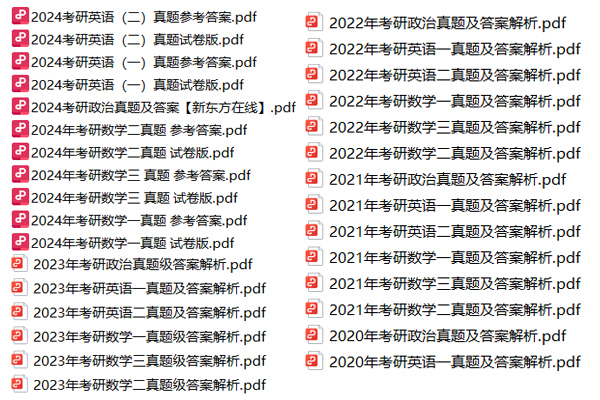
北京大学考研真题资料-专业课


以上就是关于“北京大学考研真题资料下载(历年汇总)”的整理,更多考研资料下载,请关注微信获取下载地址。
2024考研公共课必背知识点汇总
发布时间:2023-01-03扫码添加【考研班主任】
即可领取资料包
2013-2023考研历年真题汇总
发布时间:2023-01-03扫码添加【考研班主任】
即可领取资料包
考研英语大纲词汇(PDF可打印)
发布时间:2023-01-03扫码添加【考研班主任】
即可领取资料包
2024考研专业课知识点总结
发布时间:2023-01-03扫码添加【考研班主任】
即可领取资料包
2023考研政治 内部押题 PDF
发布时间:2022-11-16扫码添加【考研班主任】
即可领取资料包
徐涛:23考研预测六套卷
发布时间:2022-11-16扫码添加【考研班主任】
即可领取资料包
考研政数英冲刺资料最新整理
发布时间:2022-11-16扫码添加【考研班主任】
即可领取资料包
23考研答题卡模板打印版
发布时间:2022-11-16扫码添加【考研班主任】
即可领取资料包
2023考研大纲词汇5500PDF电子版
发布时间:2022-07-28扫码添加【考研班主任】
即可领取资料包
考研历年真题(公共课+专业课)
发布时间:2022-07-28扫码添加【考研班主任】
即可领取资料包
考研英语阅读100篇附解析及答案
发布时间:2022-01-07扫码添加【考研班主任】
即可领取资料包
新东方考研学霸笔记整理(打印版)
发布时间:2022-01-07扫码添加【考研班主任】
即可领取资料包
2001-2021年考研英语真题答案(可打印版)
发布时间:2022-01-07扫码添加【考研班主任】
即可领取资料包
考研英语词汇5500(完整版下载)
发布时间:2022-01-07扫码添加【考研班主任】
即可领取资料包
2022考研政审表模板精选10套
发布时间:2022-01-07扫码添加【考研班主任】
即可领取资料包
历年考研真题及答案 下载
发布时间:2021-12-09扫码添加【考研班主任】
即可领取资料包
考研政审表模板汇总
发布时间:2020-06-17扫码添加【考研班主任】
即可领取资料包
近5年考研英语真题汇总
发布时间:2020-06-17扫码添加【考研班主任】
即可领取资料包
考研英语大纲词汇5500
发布时间:2020-06-17扫码添加【考研班主任】
即可领取资料包
2022考研12大学科专业排名汇总
发布时间:2019-11-21扫码添加【考研班主任】
即可领取资料包
2023考研政治复习备考资料【珍藏版】
发布时间:2019-11-21扫码添加【考研班主任】
即可领取资料包
考研英语万能模板+必备词汇+范文
发布时间:2019-11-21扫码添加【考研班主任】
即可领取资料包
考研数学一、二、三历年真题整理
发布时间:2019-11-21扫码添加【考研班主任】
即可领取资料包

添加班主任领资料
添加考研班主任
免费领取考研历年真题等复习干货资料

 推荐阅读
推荐阅读
中国中医科学院学科评估结果排名是广大考生和家长朋友们十分关注的问题, 关于大学的第五轮学科评估具体结
中国原子能科学研究院学科评估结果排名是广大考生和家长朋友们十分关注的问题, 关于大学的第五轮学科评估
中国农业科学院学科评估结果排名是广大考生和家长朋友们十分关注的问题, 关于大学的第五轮学科评估具体结
关于大学的第五轮学科评估具体结果,大家也比较关心,学科评估是大学科研实力的具体体现。目前官方还未公
关于大学的第五轮学科评估具体结果,大家也比较关心,学科评估是大学科研实力的具体体现。目前官方还未公

 资料下载
资料下载
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
新东方在线考研资料合集
下载方式:微信扫码,获取网盘链接

目录:
1.2013-2023年近10年政数英真题及解析PDF版(新东方)
2.2013-2023年专业课考试历年真题及解析PDF版
3.24考研复习备考资料大合集:大纲+备考资料+词汇书+考前押题+自命题
资料介绍:
1.2013-2023年近10年政数英真题及解析PDF版(新东方)
 、
、
2.2013-2023年专业课考试历年真题及解析PDF版


3.24考研复习备考资料大合集

3.24考研复习备考资料:考研大纲

3.24考研复习备考资料:政数英备考资料+自命题真题

------------------
考研备考过程中,尤其是专业课部分,参考往年的考试真题,对于我们的复习有更好的帮助。北京大学考研真题资料都有哪些?小编为大家进行了汇总。
北京大学考研真题资料-公共课

北京大学考研真题资料-专业课


以上就是关于“北京大学考研真题资料下载(历年汇总)”的整理,更多考研资料下载,请关注微信获取下载地址。
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包
扫码添加【考研班主任】
即可领取资料包

 阅读排行榜
阅读排行榜
 相关内容
相关内容